Hibridləşmə anlayışı

Hibridləşmə anlayışı — ümumiləşmə anlayışıdır. Hibrid anlayışının əsasını atomun valent halında (atomun birləşmənin tərkibindəki halı) ayrı-ayrı ilkin orbitalların müəyyən prinsiplər üzrə hibridləşməsi (ümumiləşməsi) təşkil edir.
Hibridləşmə anlayışının izahı[redaktə | mənbəni redaktə et]
Karbon atomu adi halda iki açıq elektrona malikdir. Lakin o asanlıqla həyəcanlı hala keçir və bu vaxt elektron cütü (2s2) açılır və onlardan biri 2p-yarımsəviyyədə olan boş xanaya keçir.

Buna müvafiq olaraq, karbon atomu həyəcanlı halında dörd kimyəvi rabitə yaradır. Yəni birləşmələrdə onun oksidləşmə dərəcəsi dördə bərabər olur. Karbon atomunun həyacanlı halında valent elektronları müxtəlif yarımsəviyyələrdə yerləşdiyi üçün onların əsasında əmələ gələn kimyəvi rabitələr öz təbiətinə görə bir-birindən fərqlənməlidir.Yəni, p-elektronların əsasında yaranan üç rabitə bir cür təbiətə, s-elektron əsasında yaranan rabitə isə başqa cür təbiətə malik olmalıdır. Lakin son illər aparılan dəqiq tədqiqatlar yuxarıda göstərilən məntiq əsasında çıxarılan nəticələrin heç birinin düzgünlüyünü təsdiq etməmişdir. Müəyyən olunmuşdur ki, metan molekulu düzgün tetraedr formasına malikdir. Molekulda kimyəvi rabitələr tetraederin mərkəzindən onun təpələrinə istiqamətlənmişdir. Bu isə öz növbəsində CH4 molekulunda bütün C—H rabitələrin uzunluğunun və aralarındakı bucaqların eyni olduğunu göstərir. Başqa sözlə, CH4 molekulunda mövcudn olan bütün kimyəvi rabitələr eyni təbiətə malikdir. Beləliklə, metan molekulunun quruluşuna dair yığılmış zəngin məlumata əsasən qəbul edilir ki, hidrogen ilə qarşılıqlı təsir zamanı karbonun valent elektronlarının yerləşdiyi yarımcəviyyələr ümumiləşir, başqa sözlə, onların arasındakı energetik fərq aradan qalxır.
Atomda ayrı-ayrı valent yarımsəviyyələrinin qarışması və nəticədə ümumi bir energetik səviyyə yaratması hadisəsi hibridləşmə adlanır.
sp-hibridləşmə[redaktə | mənbəni redaktə et]

Bu prosesdə iştirak edən orbitallara hibrid orbitallar, elektronlara isə hibrid elektronlar adı verilmişdir. Bir s- və bir p- orbitalının hibridləşməsi sp hibridləşmə kimi göstərilir.
sp2-hibridləşmə[redaktə | mənbəni redaktə et]

Bir s- və iki p- orbitalının hibridləşməsi sp2 kimi göstərilir.
sp3-hibridləşmə[redaktə | mənbəni redaktə et]
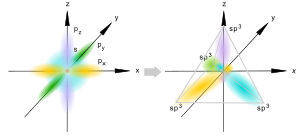
Bir s- və üç p- orbitalının hibridləşməsi sp3 kimi göstərilir.
Hibridləşmə və molekulların həndəsi quruluşu[redaktə | mənbəni redaktə et]
Göstərilən molekulların simmetrik formalarından aydın olur ki, onların fəza quruluşu sp-, sp2-, sp3- hibrid orbitalların oxlarının eyni müstəvi üzərində bir-birilə müvafiq surətdə 180o, 120o və 109o 28′ -li bucaq əmələ gətirməsinə əsaslanır.
Mənbə[redaktə | mənbəni redaktə et]
- Z.Qarayev "Qeyri-üzvi kimya", Maarif -1975.
- Полинг Л. Природа химической связи / Пер. с англ. М. Е. Дяткиной. Под ред. проф. Я. К. Сыркина. — М.; Л.: Госхимиздат, 1947. — 440 с.
- Полинг Л. Общая химия. Пер. с англ. — М.: Мир, 1974. — 846 с.
- Минкин В. И., Симкин Б. Я., Миняев Р. М. Теория строения молекул. — Ростов-на-Дону: Феникс, 1997. — С. 397-406. — ISBN 5-222-00106-7.
- Гиллеспи Р. Геометрия молекул / Пер. с англ. Е. З. Засорина и В. С. Мастрюкова, под ред. Ю. А. Пентина. — М.: Мир, 1975. — 278 с.




