Tetraflüoretilen
| Tetraflüoretilen | |
|---|---|
 | |
 | |
| Ümumi | |
| Sistematik adı | Tetraflüoretilen |
| Kimyəvi formulu | C2F4 |
| Molyar kütlə | 100,016 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 1,43; 1,50138(0°C), 1,4555 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | −131,15 °S |
| Qaynama nöqtəsi | −76,5 °S |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 116-14-3 |
| PubChem | 8301 |
| ChEBI | 38866 |
| ChemSpider | 8000 |
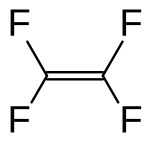
Tetraflüoretilen - C2F4 kimyəvi formulu olan karbon və flüorun üzvi birləşməsidir, flüorolefinlərin nümayəndələrindən biridir - doymamış flüor üzvi birləşmələrin.
Fiziki xassələri
[redaktə | mənbəni redaktə et]Tetraflüoretilen ağır qazdır (havadan demək olar ki, 3,5 dəfə ağırdır), rəngsiz və qoxusuzdur. Tetraflüoretilen molekulu düzdür, C–C nüvələrarası məsafə 1,33±0,06 Å, C–F nüvələrarası məsafə 1,30±0,02 Å, F–C–F bucaq arası rabitə 114±3°-dir.
Alınması
[redaktə | mənbəni redaktə et]Laboratoriya şəraitində 1,2-dibromtetraflüoretanı sinklə debromlaşma reaksiyasına uğradaraq tetraflüoretileni almaq olar:
- ,
və ya texniki vakuumda politetraflüoretileni depolimerləşdirərək:
- .
Tetraflüoretilen sənayedə diflüorxlorometandan (freon-22) alınır. Proses iki mərhələdən ibarətdir:
- .
- ,
- .
Birinci mərhələdə xloroformu susuz hidrogen flüoridlə flüorlaşdırırıq. Bu proses avtoklavda təxminən 100°C temperaturda və 3 MPa təzyiqdə azot oksidinin iştirakı ilə aparılır. Monodiflüorxlormetanın çıxımı 80% təşkil edir.
İkinci mərhələdə tetraflüoretileni diflüorxlorometa- nın (freon-22) pirolizi nəticəsində alırıq. Diflüorxlormetanın pirolizi gümüş boru şəklində olan reaktorda 600-800°C temperaturda aparılır. Tetraflüoretilenin çıxımı 90%-dən çox təşkil edir. Təmiz tetraflüoretilen otaq temperaturundan aşağı temperaturda polimerləşir. Buna görə də, o polimerləşmə inhibitorı olan - butilmerkaptanın (0,5%) iştirakı ilə saxlanılır.
Kimyəvi xassələri
[redaktə | mənbəni redaktə et]Palladium katalizatorunda tetraflüoretilen hidrogenlə birləşir və 1,1,2,2-tetraflüoretan alınır:
- .
Ağır şəraitdə tetraflüoretilen oksigendə yanaraq tetraflüormetan və karbon qazı alınır:
- .
Yüksək temperaturda tetraflüoretilen tsiklodimerləşmə reaksiyasına uğrayaraq oktaflüortsiklobutan alınır:
- .
Tetraflüoretilenin pirolizi heksaflüorpropilenin alınması ilə müşayiət olunur:
- .
Tətbiqi
[redaktə | mənbəni redaktə et]Tetraflüoretilen əsasən teflonun istehsalında istifadə olunur.
Toksikliyi Tetraflüoretilen zəhərli maddədir. Gözün və tənəffüs orqanlarının selikli qişasını qıcıqlandırır, yüksək konsentrasiyalarda mərkəzi sinir sisteminə mənfi təsir göstərir, ağciyərdə iltihaba səbəb olur. Ölümcül doza 200-955 мг/кг-dır.
İstinadlar
[redaktə | mənbəni redaktə et]- Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: ГНТИ Химической литературы, 1962. — Т. 1. — С. 358. — 1072 с.
- Məhərrəmov A.M., Allahverdiyev M.Ə. Üzvi kimya, BDU, Bakı, 2007.

![{\displaystyle {\ce {[-CF2-CF2-]}}_{n}\xrightarrow {600-700\ ^{\circ }{\text{C}},\ 130-700\ {\text{Па}}} n~{\ce {CF2=CF2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f02afc91cedf1a6ce9e77e87855b95f53ec19327)






