Borazol
Bu məqaləyə hansısa kateqoriya əlavə edilməmişdir. Məqaləyə kateqoriyalar əlavə edərək töhfə verə bilərsiz. |
| Borazol | |
|---|---|
 | |
 | |
| Ümumi | |
| Kimyəvi formulu | B₃H₆N₃[1] |
| Molyar kütlə | 0 kq[1] |
| Fiziki xassələri | |
| Sıxlıq | 0,81 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | −58 °C[2] |
| Qaynama nöqtəsi | 55 °C, 53 °C[2] |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 6569-51-3 |
| PubChem | 138768 |
| ChEBI | 33119 |
| ChemSpider | 122374 |
Borazol(heksahidro-1,3,5,2,4,6-triazotribor(borazin, triborin triimid)) - Kimyəvi formulu B3 H6N3, digər adları borazol, borazin, triborin triimidi, rəngsiz maye haldadır.
İzahı[redaktə | mənbəni redaktə et]
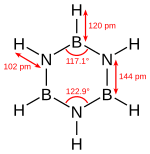
Molekul bor və azot atomlarının bir-birini əvəz etdiyi, hər biri bir hidrogen atomuna bağlı olan altı üzvlü hamar halqadır. Borazol azot atomunun bor ilə əvəz olunduğu piridinin analoqu olan borabenzol ilə qarışdırılmamalıdır.
Borazol molekulu benzol molekuluna izoelektrondur və oxşar quruluşa malikdir. Borazolda nüvələrarası məsafənin azalması (d(B-N) = 0,144 nm tək rabitə ilə müqayisədə d(B-N) = 0,154 nm) π-elektronların delokalizasiyası ilə əlaqədardır. Elektron sıxlığının paylanması effektiv yüklərə uyğundur. Borazolunreaksiya qabiliyyəti benzoldan daha yüksəkdir, çünki rabitələrin polyarlaşması (üç azot atomu öz tək elektron cütlərini bor atomlarının sərbəst orbitallarına verir). Beləliklə, o, havada oksidləşir, suda həll olunur, onunla tədricən reaksiyaya girərək B(OH)3, NH3 və H2 əmələ gətirir və benzoldan daha az istiliyə davamlıdır. Borazol yanar maddədir, hava ilə partlayıcı qarışıqlar əmələ gətirir.
Kimyəvi xassələri[redaktə | mənbəni redaktə et]
Borazol fiziki xassələrinə görə benzola bənzəyir (məcmu vəziyyət, qaynama diapazonu, sıxlıq və s.); eyni zamanda, borazol və benzolun kimyəvi xassələri kəskin şəkildə fərqlənir. B atomlarına bağlı olan H atomları tsikli pozmadan dəyişdirilə bilər. Beləliklə, BCl3 və ya BBr3-ün borazola təsiri altında qızdırıldıqda bərk sabit birləşmələr - trihalogenborazollar B3N3H3Hal3 əmələ gəlir. N-dəki H atomları əvəzetmə reaksiyalarına daxil ola bilmirlər:
Alınması[redaktə | mənbəni redaktə et]
Borazol litium tetrahidroborat və ammonium xlorid qızdırmaqla əldə edilə bilər:
Diboranın ammonyak ilə reaksiyasına görə, qızdırıldıqda sintez həyata keçirilir:
- 3 B2H6 + 6 NH3 → 2 B3H6N3 + 12 H2
Bor trixloridin ammonium xlorid ilə reaksiyası. Reaksiya iki mərhələdə gedir:
Borazinin trimerizasiyası (azot və bor arasında üçlü rabitə ilə):
Molekulda alkilen, siloksan, karboran və digər fraqmentləri olan borazolun alkil və ya aril törəmələrinə əsaslanan məlum polimerlər mövcuddur. [(CH3)3N3B3(CH2)6—]14, 400-600 °C-də davamlıdır.
Mənbə[redaktə | mənbəni redaktə et]
- Karapetyants M. X. Drakin S. I. Ümumi və qeyri-üzvi kimya. M.: Kimya 1994
- Kimya Ensiklopediyası / Red.: Knunyants I.L. və başqaları.- M .: Sovet Ensiklopediyası, 1988. - T. 1 (Abl-Dar). — 623 s.
- Джерард В., Химия органических соединений бора, пер. с англ., М., 1966; Ниденцу К.,
- Даусон Дж., Химия боразотных соединений, пер. с англ., М., 1968;
- Коршак В. В., Замятина В. А., Бекасова Н. И., Борорганические полимеры, М., 1975;
- Greenwood N. N., в кн.: Comprehensive inorganic chemistry, v. 8, Oxf.-[a.o.], 1975, p. 665-991. Н.Т. Кузнецов.
- ↑ 1 2 AC1L3DJA (ing.).
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (ing.): A CRC quick reference handbook. CRC Press, 1993. ISBN 978-0-8493-4498-5



