Ftal turşusu
| Ftal turşusu | |
|---|---|
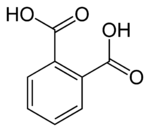 | |
 | |
| Ümumi | |
| Ənənəvi adı | Benzol-1,2-dikarboksil ftal turşusu |
| Kimyəvi formulu | C₈H₆O₄[1] |
| Molyar kütlə | 166,14 q/mol |
| Fiziki xassələri | |
| Sıxlıq | 1,593 q/sm³ |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | 191 °S |
| Qaynama nöqtəsi | 168 °S |
| Molyar istilik tutumu (n.ş.) | 1,114 C/(mol•K) |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 88-99-3 |
| PubChem | 1017, 18183610 |
| ChEBI | 29069 |
| ChemSpider | 992 |
Ftal turşusu' — (1,2-benzoldikarbon turşusu, ortoftal turşusu olaraq da bilinir[8]) — üzvi maddədir;iki əsaslı aromatik karbotsiklik turşuların ən sadə nümayəndəsidir. Onun duzlarına və efirlərinə ftalatlar deyilir. Tereftal və izoftal turşularının izomeridir. İysiz, rəngsiz monokristaldır.
Tarixi
[redaktə | vikimətni redaktə et]Ftal turşusu ilk dəfə 1836-cı ildə fransız kimyaçısı Auguste Laurent tərəfindən alınmışdır[4]. O, naftalin tetraxloridi oksidləşdirərək ortoftal turşusunu əldə edib. Əldə etdiyi maddənin naftalinin törəməsi olduğunu zənn edərək, ona "naftalin turşusu"demişdir.[4][5] [ İsveçrəli kimyaçı Jean Charles Galissard de Marignac düzgün formulunu təyin etdikdən sonra,[6] Laurent indiki adını verdi. .[4][7 XIX əsrdə istehsal üsulları, naftalin tetraxloridinin nitrat turşusu ilə oksidləşməsini və ya daha yaxşı olaraq, katalizator kimi civə və ya civə (II) sulfatdan istifadə edərək, dumanlanan sulfat turşusu ilə karbohidrogenin oksidləşməsini əhatə edirdi. .[4]
Alınması
[redaktə | vikimətni redaktə et]Ftal turşusu kommersiya baxımından əhəmiyyətli bir məhsul deyil. Ftal anhidrid istehsalıbnda yan məhsul olaraq əmələ gəlir[9]. Laboratoriya şəraitində ftal turşusu sudan kristalizasiya yolu ilə təmizlənir Naftalin kalium permanqanat və ya kalium dixromat ilə oksidləşərək ftal turşusunu əmələ gətirir.
Fiziki xassələri
[redaktə | vikimətni redaktə et]Ftal turşusu rəngsiz monoklinik kristallar şəklində mövcuddur. 211 °C. metanolda 18,5% (19 °C), etanolda 11,0% (19 °C), dietil efirdə (15 °C) 0,68% -dir. Sirkə turşusunda 12,0% (100 °C), karbon tetrakloriddə 0,24% (28 °C), 0,45% benzolda (28 °C), 2,89% asetonda (28 °C). Temperatur artdıqca suda həll olma qabiliyyəti artır: 0,7%-li 25 °C-də, 1,47%-li 45 °C-də, 8,33%-li 85 °C-də, 19,0%-li 100 °C-də[2].
Kimyəvi xassələri
[redaktə | vikimətni redaktə et]Ftal turşusu qızdırıldıqda su ayrılır və ftal anhidridinə çevrilir. Hiqroskopik maddələrlə qarşılıqlı təsirdə olduqda da anhidrid əmələ gətirir. Fosfor (V) xloridin təsiri altında müvafiq ftalol xloridə çevrilir[2]. Ftal turşusu elektrofilik əvəzetmə reaksiyalarına daxil olur: Neytral su mühitində 4-xloro törəməsi daha sonra isə 4,5-dixlor törəməsi əmələ gəlir. Turş mühitdə, aromatik halqanın əvəzedilməsi dörd vəziyyətdə gedir. Ftal turşusunun nitratlaşaraq 3 və 4-nitro törəmələr əmələ gətirir] [2].
Təhlükəsizliyi
[redaktə | vikimətni redaktə et]Ftal turşusu zəhərli maddədir[11][12]. QOST 12.1.007.76 uyğun olaraq, ftal turşusu, bədənə məruz qalma dərəcəsi baxımından 2-ci təhlükə sinfi kimi qiymətləndirilir yüksək təhlükəli bir maddədir[13]. Çox miqdarda maddə göz və dərinin selikli qişalarını qıcıqlandırır… Ftal turşusu üçün iş sahəsinin havasında tövsiyə olunan maksimum konsentrasiya həddi 0,5 mq / m –dir [14], siçovullar üçün LD50 təxminən 136 mq / kq təşkil edir[15].
Əsas tətbiq sahələri
[redaktə | vikimətni redaktə et]Ortoftal turşusu və onun bir sıra törəmələri (dinonil ftalat dimetil ftalat, diizooktil ftalat, ftal anhidrit, dipentil ftalat, dietil ftalat), əsasən dərman maddələri istehsalında istifadə olunur, polivinilxlorid üçün boyalar və plastikləşdiricilər. Bir çox ftalatlar, aşağı fitotoksisit ilə xarakterizə olunan partlayıcı və yanğın təhlükəlidir[16].
Bioloji xassələri
[redaktə | vikimətni redaktə et]Estrogen quruluşuna bənzəyən ftalatlar endokrin pozulmasına səbəb ola bilər. Heyvanlar və insanlar üzərində aparılan araşdırmalar ftalatların testosteronun təsirini zəiflədə biləcəyini göstərir. [17][18][19][20]
İstinadlar
[redaktə | vikimətni redaktə et]- ↑ phthalic acid (ing.).
- Sigma-Aldrich. Phthalic acid. Дата обращения: 7 июня 2014.
- ↑ Перейти обратно:1 2 3 4 5 Химическая энциклопедия / Гл. ред. Н. С. Зефиров. — М.: Большая российская энциклопедия, 1998. — Т. 5. — С. 192–193.
- ↑ name=https://docs.cntd.ru_ГОСТ[ölü keçid] (недоступная ссылка) 12.1.005–88. ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- Chisholm, Hugh, ed. (1911). "Phthalic Acids" . Encyclopædia Britannica. 21 (11th ed.). Cambridge University Press. pp. 545–546.
- ^ See:
- 1. Auguste Laurent (1836) "Sur l'acide naphtalique et ses combinaisons" (On naphthalic acid and its compounds), Annales de Chimie et de Physique, 61 : 113–125. (Note: The empirical formulae of the compounds that were analyzed in this article are incorrect, in part because, during this period, chemists used incorrect atomic masses for carbon (6 instead of 12) and other elements.)
- 2. Reprinted in German as: Auguste Laurent (1836) "Ueber Naphthalinsäure und ihre Verbindungen" (On naphthalenic acid and its compounds), Annalen der Pharmacie, 19 (1) : 38–50; for the preparation of phthalic acid, see page 41.
- ^ C. de Marignac (1841) "Ueber die Naphtalinsäure und ein bei ihrer Darstellung entstehendes flüchtiges Produkt" ("On naphthalinic acid and a volatile product that arises during its preparation"), Annalen der Chemie und Pharmacie, 38 (1) : 13–20. (Note: Again, Marignac's empirical formulae are wrong because chemists at this time used incorrect atomic masses.)
- ^ See:
- 1. Auguste Laurent (1841) "Sur de nouvelles combinaisons nitrogénées de la naphtaline et sur les acides phtalique et nitrophtalique" (On new nitrogenous compounds of naphthalene, and on phthalic acid and nitrophthalic acid), Revue Scientifique et Industrielle, 6 : 76–99; on page 92, Laurent coins the name "acide phtalique" (phthalic acid) and admits that his earlier empirical formula for phthalic acid was wrong.
- 2. Reprinted in German as: Auguste Laurent (1842) "Ueber neue stickstoffhaltige Verbindungen des Naphtalins, über Phtalinsäure und Nitrophtalinsäure" (On new nitrogenous compounds of naphthalene, on phthalic acid and nitrophthalic acid), Annalen der Chemie und Pharmacie, 41 (1) : 98–114; on page 108, Laurent coins the name "Phtalinsäure" (phthalic acid).
- ↑ name=https://base.safework.ru_Phthalic[ölü keçid] acid
- ↑ name=https://docs.cntd.ru_ГОСТ[ölü keçid] (недоступная ссылка) 12.1.005.76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ name=https://docs.cntd.ru_Опасности[ölü keçid] по ГН-98
- ↑ name=https://docs.cntd.ru_Меры[ölü keçid] (недоступная ссылка)безопасности при работе с фталевой кислотой
- name=https://docs.сntd.ru_Фталаты[ölü keçid] и их свойства
- ↑ Фталаты подозреваются в феминизации мальчиков (31 мая 2005).
- ↑ Swan S. H., Main K. M., Liu F., Stewart S. L., Kruse R. L., Calafat A. M., Mao C. S., Redmon J. B., Ternand C. L., Sullivan S., Teague J. L. Decrease in anogenital distance among male infants with prenatal phthalate exposure (англ.) // Environ. Health Perspect. (англ.)русск. : journal. — 2005. — August (vol. 113, no. 8). — P. 1056–1061. — doi:10.1289/ehp.8100. — PMID 16079079.
- ↑ Fisher J. S. Environmental anti-androgens and male reproductive health: focus on phthalates and testicular dysgenesis syndrome (англ.) // Reproduction : journal. — 2004. — March (vol. 127, no. 3). — P. 305–315. — doi:10.1530/rep.1.00025. — PMID 15016950.
- ↑ Barrett, J. R. Phthalates and Baby Boys: Potential Disruption of Human Genital Development (англ.) // Environmental Health Perspective : journal. — Brogan &, 2005. — Vol. 113, no. 8. — P. 542–542. — doi:10.1289/ehp.113-a542a. — JSTOR 3436340.
Mənbə
[redaktə | vikimətni redaktə et]• Sigma-Aldrich. ЯМР-спектр фталевой кислоты. Дата обращения: 7 июня 2014. • Sigma-Aldrich. КР-спектр фталевой кислоты. Дата обращения: 7 июня 2014.