İzotermik proses

İzotermik proses (yun. ἴσος -bərabər və θέρμη - isti) — sabit temperaturda sistemin halının dəyişməsi.[1] Bu prosesdə temperatur sabit qalır: ΔT = 0. Havanın tədricən sıxılma prosesini və ya qabdan qazı sorub çıxaranda nasosun porşeni altında qazın genişlənməsini təxmini olaraq izotermik proses hesab etmək olar. İzotermik prosesi həyata keçirmək üçün adətən, sistemə termostat tətbiq edilir. Bu zaman prosesin dövrədəən keçirilməsi daha da tezləşir. Sistemin temperaturu isə termostatın temperaturundan fərqlənmir. İzotermik proses elə prosesdir ki, qazın çəkisi, molyar qaz və temperatur є -konstant sayılırlar.[2]
İzotermik proses və Boyl-Mariott qanunu[redaktə | mənbəni redaktə et]

İzotermik proses və Boyl-Mariott qanunu arasında sxematik əlaqə vardır. İzotermik proses Boyl-Mariott qanununun hesabına izah edilir. Boyl-Mariott qanununda deyilir:
|
"Sabit temperaturda verilmiş kütləli ideal qazın təzyiqinin həcminə hasili sabit qalır" |
"Boyl-Mariott qanunu" aşağıdakı düstur ilə ifadə olunur:
və ya:
- — qazın təzyiqi
- isıə qazın həcmidir
Riyazi olaraq aşağıdakı kimi yazılır:
Düsturları nəzərdən keçirsək aşağıdakı nisbətləri alırıq:
- və ya
Boyl-Mariott qanununun[3] qrafikinə nəzər salsaq görərik ki, P və V qrafiki hiperbolik əyridən ibarətdir. Yəni P V ilə tərs mütənasibdir. İzotermik prosesdə də belədir. Buradan aydın olur ki, doğrudan da, izotermik proses Boyl-Mariott qanununun sayəsində izah edilir.
İzotermik prosesin ideal qazlara tətbiqi[redaktə | mənbəni redaktə et]


Mendeleyev-Klapeyron tənliyinin (İdeal qazın hal tənliyi) düsturu aşağıdakı kimidir:
- və ya
burada:
- p — təzyiq
- V — həcm
- m — kütlə
- T — qazın temperaturu
- M — qazın molyar kütləsi
- R isə universal qaz sabitidir.
Daimi kütləli qazın müxtəlif nisbətləri müxtəlif səviyyələrdə ola bilər:
Bu nisbətlərdən də kütləsi dəyişməyən qaz üçün aşağıdakı tənlikləri alırıq:
və ya:
Əgər İzotermik proses Klapeyron tənliyinə tətbiq edilsə, onda temperatur bir-birinə bərabər olur. Bu zaman aşağıdakı düsturlar alınır:
və ya:
İdeal qazların[4][5] İzotermik prosesdə hərəkəti Boyl-Mariott qanununun[6][7][8] köməyi ilə izah edilir. Buradan aşağıdakı nəticəni alırıq:
|
"Sabit temperaturda verilmiş kütləli ideal qazın təzyiqinin həcminə hasili sabit qalır" |
İzotermik prosesin termodinamikanın birinci qanununa tətbiqi[redaktə | mənbəni redaktə et]
İzotermik prosesi termodinamikanın birinci qanununa tətbiq etmək olar. Onda bu zaman aşağıdakı düstur alınır:
və ya:
İzotermik prosesdə görülən iş[redaktə | mənbəni redaktə et]
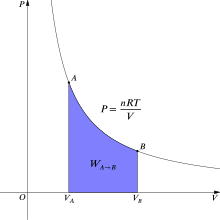

İzotermik prosesin İşə tətbiqi zamanı İnteqral üsulundan istifadə edilir. Bu zaman aşağıdakı nəticələr alınır:
- olarsa[9] onda:
Bu zaman aşağıdakı düsturlar alınır:
burada:
Bəzən bu düsturları aşağıdakı kimi də yazırlar:
Bəzən də W işarəsi A ilə göstərilir:
Yaxud, düsturda ln-nin yerinə log-ifadəsini də daxil etmək olar. Onda düsturlar aşağıdakı kimi olar:
Həmçinin, R-in yerinə k mütənasiblik əmsalı yazılır:
burada:
- — qazın hissəsinin ədədi.
- — temperatur.
- и — prosesin əvvəlindəki və sonundakı qazın həcmi.
- isə Bolsman sabitidir.
İzotermik prosesdə entropiyanın dəyişməsi[redaktə | mənbəni redaktə et]

İzotermik prosesdə entropiyanın dəyişməsi baş verir. Bu zaman aşağıdakı düsturlar yaranır:
burada:
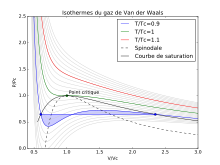
Van-der-Vaalsda izotermik proses[redaktə | mənbəni redaktə et]

Bir mol qaz üçün Van-der-Vaals tənliyi aşağıdakı kimi yazılır:
burada:
- — təzyiq
- — molyar həcm
- — mütləq temperatur
- isə universal qaz sabitidir
İstənilən mol qaz üçün Van-der-Vaals tənliyi isə aşağıdakı kimidir:
burada:
- — həcm
Van-der-Vaals izotermik proses vardır. Onun qrafikində P V ilə asılıdır. Yalnız bu asılılıqda P V ilə müxtəlif temperaturlarda asılıdır.
Buxarla gedən proseslər[redaktə | mənbəni redaktə et]
Nəm buxar qaynama temperaturunda olur. Həmçinin, maye ilə quru doymuş buxarın qarışığından ibarət olduğundan, onun həcmi qarışığın həcmi kimi tapılır. Nəm buxar sahəsində izotermik proses izobar prosesinə uyğun olur. Deməli, burada izotermik prosesi izobar prosesi kimi qiymətləndirmək olar.
İzotermik prosesin yaranması[redaktə | mənbəni redaktə et]
İzotermik prosesin yaradılması üçün temperaturda olan qazın həcmini dəyişdirmək lazımdır. Qaynama hadisəsi və ya təzyiqdə olan sərt cismin suda üzməsi izotermik prosesə misal ola bilər. İzotermik prosesdə daxili işin görülməsi baş verir. Bu zaman bütün iş daxili işin görülməsinə sərf edilir. Sərt cisimdə və ya maye olan böyük yerdə izotermik proses cismin həcmini az dəyişdirir. Əgər faza keçməsi baş verərsə, onda sərt cismin və ya maye olan böyük yerdə izotermik proses cismin həcmini çox dəyişdirir. Bəzən izotermik prosesin həyata keçirilməsi üçün cismi Termostata yerləşdirirlər. Bu zaman mənbə də yaradıla bilər. Eyni zamanda Termometr ilə istiliyi ölçmək olar. Əgər izotermik proses yavaş gedirsə, onda termodinamik proses pozulmur. Bu zaman proses Dönən proses olur. İzotermik tez baş verirsə, onda bu zaman tarazlıq pozulur və proses dönməz proses olur. Dönməz prosesə Qısıq misal göstərilə bilər. Qısıqda temperatur dəyişkən olur. İzotermik prosesi daha aydın göstərmək üçün qrafikindən istifadə olunur. İzotermik prosesin qrafiki isə "İzoterm əyrisi" adlanır.
İzotermik prosesdə təzyiq[redaktə | mənbəni redaktə et]
İzotermik prosesdə təzyiqin necə baş verdiyini ətraflı müşahidə etmək üçün porşenlə sıxılmış kolbaya baxmaq lazımdır. Əgər porşeni kolbanın içində aşağıdan yuxarıya qaldırdıqda, qazaın genişlənməsi baş verir. Bu zaman təzyiq azalır. Lakin porşeni kolbanın içində yuxarıdan aşağıya sıxdıqda, qazın sıxılması baş verir. Bu zaman isə təzyiq artır. Həmin hadisələri P ilə V qrafikində müşahidə etmək mümkündür.[10]
Tətbiqi[redaktə | mənbəni redaktə et]

İzotermik proseslər istənilən sistem növündə baş verə bilər. Yüksək strukturlaşdırılan maşınlar buna misal ola bilər. Bəzi yüksək hərarət mühərrikinin dövrələrinin müxtəlif hissələri yerinə yetirilən İzotermik proseslər və Karno dövrəsi ilə yaxınlaşdırıla bilər. Həmçinin, ərimə və faza dəyişiklikləri də izotermik proseslərdir.
Mükəmməl qaz üçün Coul qanununa görə, daxili enerji tam hərarətin funksiyasıdır. İzotermik prosesdə hərarət daimidir və ya dəyişməzdir. Beləliklə, daxili enerji də daimidir və ya dəyişməzdir. Daxili enerjidə təmiz dəyişiklik sıfırdır.
Mükəmməl və ya ideal qaz çərçivəsində, heç bir molekullararası qüvvələr yoxdur və qaz molekulları olduqca sonsuz kiçikdir. Buna baxmayaraq, real təmiz maddə üçün molekullararası qüvvələrə üstün gəlməkdə istifadə edilən enerjiyə müvafiq gələn daxili enerjinin komponenti var.
İzotermik prosesdə qazın həcmi dəyişəndə, hər molekul dəyişikliklərinin arasında orta ədəd məsafəsi də dəyişir. Beləliklə, əgər real təmiz qaz İzotermik prosesə məruz qalırsa, daxili enerjinin daxili temperatur bir yerdə ola bilən bu komponentində təmiz dəyişiklik var.[11][12][13][14][15]
Ədəbiyyat[redaktə | mənbəni redaktə et]
- M.C.Məmmədova İstilik texnikası, Azərnəşr, Bakı, 1963, 240 s.
- Ə.M.Məmmədov, Ə.H.Hüseynzadə Ümumi istilik texnikası, Maarif, Bakı, 1973, 264
- Physics for Scientists and Engineers — with Modern Physics (6th Edition), P. A. Tipler, G. Mosca, Freeman, 2008, ISBN 0 7167 8964 7
- Encyclopaedia of Physics (2nd Edition), R.G. Lerner, G.L. Trigg, VHC publishers, 1991, ISBN (Verlagsgesellschaft) 3-527-26954-1, ISBN (VHC Inc.) 0-89573-752-3
- McGraw Hill Encyclopaedia of Physics (2nd Edition), C.B. Parker, 1994, ISBN 0-07-051400-3
- Physics with Modern Applications, L.H. Greenberg, Holt-Saunders International W.B. Saunders and Co, 1978, ISBN 0-7216-4247-0
- Essential Principles of Physics, P.M. Whelan, M.J. Hodgeson, 2nd Edition, 1978, John Murray, ISBN 0 7195 3382 1
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9.
- Савельев И. В. Курс общей физики:Волны.Оптика. — М.: Астрель, 2001. — Т. 4. — 256 с. — 7000 экз. — ISBN 5-17-004586-7.
- Ландау Л.Д., Ахиезер А.И., Лифшиц Е.М. Курс общей физики: Механика. Молекулярная физика.. — М.: Наука, 1965.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика Часть 1 // Теоретическая физика. — М.: Наука, 1976. — Т. V. — 584 с. — 45 000 экз.
- Сивухин Д. В. Общий курс физики. — М.: МФТИ, 2005. — Т. I. Механика. — 560 с.
- Сивухин Д. В. Общий курс физики. — М.: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
- П. С. Кудрявцев История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25000 экз.
- В.А. Кириллин, В.В. Сычев, А.Е. Шейндлин Техническая термодинамика: учебник для вузов. — М.: Издательство МЭИ, 2008. — 496 с.
- Thermodynamics, From Concepts to Applications (2nd Edition), A. Shavit, C. Gutfinger, CRC Press (Taylor and Francis Group, USA), 2009, ISBN (13-) 978-1-4200-7368-3
- Chemical Thermodynamics, D.J.G. Ives, University Chemistry, Macdonald Technical and Scientific, 1971, ISBN 0356-03736-3
- Elements of Statistical Thermodynamics (2nd Edition), L.K. Nash, Principles of Chemistry, Addison-Wesley, 1974, ISBN 0-201-05229-6
- Statistical Physics (2nd Edition), F. Mandl, Manchester Physics, John Wiley & Sons, 2008, ISBN 9-780471-91533
- White Frank M. Fluid Mechanics — 4th. — McGraw-Hill, New York., 1998. — ISBN 978-0072281927.
- rient Blackswan, 1990. — P. 85–88. — 480 p. — ISBN 9780861319596.
- 4th Ed.. — Taylor & Francis, 2003. — P. 47. — 618 p. — ISBN 9781560329923.
- Springer, 1993. — P. 141. — 212 p. — (Macmillan physical science). — ISBN 9781563960307.
- Nuclear Physics. — Academic Press, 1963. — Vol. 5. — P. 187. — 886 p. — (Methods in Experimental Physics). — ISBN 9780124759459.
İstinadlar[redaktə | mənbəni redaktə et]
Bu məqalədəki istinadlar müvafiq istinad şablonları ilə göstərilməlidir. |
- ↑ Изотермический процесс[ölü keçid] Yoxlanılıb: 12 sentyabr 2014
- ↑ Изотермический процесс Arxivləşdirilib 2022-08-02 at the Wayback Machine Flash-fizika.narod.ru, Yoxlanılıb: 12 sentyabr 2014
- ↑ BBK.ac.uk The Boyle Papers, BP 10, fol. 138v-139r Arxivləşdirilib 2009-11-22 at the Wayback Machine Yoxlanılıb: 12 sentyabr 2014
- ↑ Levine, Ira. N (1978). "Physical Chemistry" University of Brooklyn: McGraw-Hill
- ↑ Levine, Ira. N. (1978), p12 gives the original definition.
- ↑ Draper, John William. A Textbook on chemistry. 1861. səh. 46. 2014-10-12 tarixində arxivləşdirilib. İstifadə tarixi: 2015-01-19.
- ↑ Gerald James Holton. Physics, the Human Adventure: From Copernicus to Einstein and Beyond. Rutgers University Press. 2001. 270–. ISBN 978-0-8135-2908-0. 2022-04-25 tarixində arxivləşdirilib. İstifadə tarixi: 2015-01-19.
- ↑ Principia, Sec.V,prop. XXI, Theorem XVI
- ↑ Ученые — Знай Наших — Центральный Еврейский Ресурс Arxivləşdirilib 2008-12-04 at the Wayback Machine Yoxlanılıb: 12 sentyabr 2014
- ↑ İzotermik prosesin animasiyası Arxivləşdirilib 2020-08-30 at the Wayback Machine Yoxlanılıb: 12 sentyabr 2014
- ↑ Beyond Belief: Enlightenment 2 – Peter Atkins The Science Network Arxivləşdirilib 2021-12-02 at the Wayback Machine Yoxlanılıb: 12 sentyabr 2014
- ↑ Изотермический процесс Arxivləşdirilib 2022-01-27 at the Wayback Machine Physics-lectures.ru, Yoxlanılıb: 12 sentyabr 2014
- ↑ Изотермический процесс Arxivləşdirilib 2020-02-16 at the Wayback Machine Phyzika.ru saytında, Yoxlanılıb: 12 sentyabr 2014
- ↑ Законы идеальных газов Arxivləşdirilib 2020-10-21 at the Wayback Machine Yoxlanılıb: 12 sentyabr 2014
- ↑ Kimyəvi termodinamika Arxivləşdirilib 2018-01-05 at the Wayback Machine Yoxlanılıb: 12 sentyabr 2014















































