Pniktogen hidrid
Bu, tənha məqalədir, çünki hansısa məqalədən bu məqaləyə verilmiş keçid yoxdur. |
Bu məqaləyə hansısa kateqoriya əlavə edilməmişdir. Məqaləyə kateqoriyalar əlavə edərək töhfə verə bilərsiz. |
Pniktogen hidridlər və ya hidrogen pniktidlər hidrogenlə kovalent rabitə ilə bağlanmış pniktogen atomlarından ibarət birləşmələrdir (V qrup elementləri: azot, fosfor, arsen və bismut).
Pniktogen trihidridlər
[redaktə | vikimətni redaktə et]Ən sadə seriya, X pniktogenlərdən birini təmsil edən XH3 (daha az yayılmış H3X) kimyəvi formuluna malikdir. Piramida quruluşa sahibdirlər (III qrup hidridlərinin trigonal düzülüşündən fərqli olaraq) və buna görə də qütblüdürlər. Bu pniktogen trihidridlər ümumiyyətlə getdikcə qeyri-sabitdir və daha ağır elementlərlə zəhərlidirlər. Sadə hidrogen halogenidlər və xalkogenidlər kimi, pniktogen hidridlər də suda həll olur. Turş sulu məhlullar əmələ gətirən hidrogen sulfid və hidrogen flüorid kimi digər hidridlərdən fərqli olaraq, ammonyak suda əridilərək əsas ammonium hidroksidi meydana gətirir (hidroniumdan fərqli olaraq hidroksid ionu əmələ gətirərək). Fosfin eyni zamanda suda həll olur. Arsin və stibin daha azdır və bismutinin olub olmadığı bilinmir.
| Birləşmənin adı | Kimyəvi formulu | Həndəsi quruluşu | Modeli |
|---|---|---|---|
| azot hidrid, ammonyak |
NH3 |  |

|
| fosfor hidrid, fosfin(fosfan) phosphine (phosphane) |
PH3 | 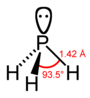 |

|
| arsen hidrid arsine (arsane) |
AsH3 |  |

|
| antimon hidrid stibine (stibane) |
SbH3 |  |

|
| bismut hidrid bismuthine (bismuthane) |
BiH3 |  |

|
Xassələri
[redaktə | vikimətni redaktə et]Bütün alifatik doymuş hidrogen pniktidlərin formulu Xn Hn+2 düsturuna malikdir.
Ammonyak bütün birləşmələr arasında böyük miqyasda sənaye üsulu ilə istehsal olunur. Su kimi, hidrogen əlaqəsi də digər pniktogen hidridləri ilə müqayisədə daha yüksək ərimə və qaynama nöqtəsi ilə nəticələnir, baxmayaraq ki, ərimədə 26% itirilir. Su kimi, əla və tez-tez istifadə olunan ionlaşdırıcı bir həlledicidir. [2] İyirmidən çox azotun hidridləri məlumdur, ən başlıcası hidrazin (N2H4) və hidrogen azid (HN3). Hidrazinin su ilə olduqca oxşar fiziki xüsusiyyətləri var: ərimə və qaynama nöqtələri 2,0 °C və 113,5 °C, −5 °C-də sıxlığı 1.146 g / sm3, mayenin 25-də °C 1.00 q / sm3-dür. [3] Azanlar ammonyak, hidrazin və triazandan təşkil olunmuş bir sıradır. Zəhərli, rəngsiz bir qaz olan fosfin ən sabit fosfor hidrididir və n artdıqca getdikcə termal olaraq qeyri-sabit hala gələn homoloq düz zəncirli polifosfan Pn Hn+2 (n = 1–9) sırasında birincidir. 1997-ci ildə PnHn-dən P nHn-18-ə qədər digər tsiklik və qatılaşdırılmış polifosfan seriyaları məlumdur ki, 1997-ci ildə 85 fosfan müəyyən olunmuşdur. Suda həll olmayan, lakin üzvi mayelərdə (həmçinin karbon disülfid və trixlorasetat turşusunda) həll olan fosfin güclü bir reduksiyaedicidir. [4] Arsin, stibin və bismutin olduqca zəhərli, istilik baxımından qeyri-sabit və rəngsiz qazlardır. Fosfində, arsində, stibində və ya bismutində nəzərəçarpacaq dərəcədə hidrogen rabitəsi aşkar olunmur və ammonyak kimi MH+ ilə ayrılma meyli yoxdur.
Arsin 250–300 °C-də arsen və hidrogenə, stibin stibium və hidrogenə qədər otaq temperaturunda, bismutin −45 °C-dən yuxarı bismut və hidrogenə qədər parçalanır. Arsin və stibin çox asanlıqla arsen və ya stibium trioksid və su ilə oksidləşirlər; bənzər bir reaksiya kükürd və ya selenium ilə baş verir. Yüksək temperaturda metallarla reaksiya arsenidlərə və antimonidlərin alınmasına səbəb olur. As2H4 kimi bir neçə hidrid məlumdur, lakin daha qeyri-sabitdir və xassələri məlum deyil. [1] Bir hidrogen atomu və bir azot atomundan (NH) ibarət radikalı olan imidogen, pniktogen hidrid kimi təsnif edilə bilər.
Həmçinin bax
[redaktə | vikimətni redaktə et]- Ammonium
İstinadlar
[redaktə | vikimətni redaktə et]- Jump up to:a b c Greenwood and Earnshaw, pp. 557–8
- Greenwood and Earnshaw, pp. 420–4
- Greenwood and Earnshaw, pp. 426–7
- Greenwood and Earnshaw, pp. 492–3
Ədəbiyyat
[redaktə | vikimətni redaktə et]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
Bu məqaləyə hansısa kateqoriya əlavə edilməmişdir. Məqaləyə kateqoriyalar əlavə edərək töhfə verə bilərsiz. (dekabr 2023) |