Karbon
| ||||||
| Ümumi | ||||||
|---|---|---|---|---|---|---|
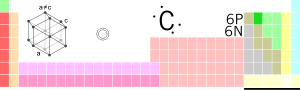
| Ad, İşarə, Nömrə | karbon, C, 6 | |||||
| Qrup, Dövr, Blok | 14, 2, p | |||||
| Xarici görünüşü | 
| |||||
| Atom kütləsi | 12.0107(8) q/mol | |||||
| Elektron formulu | 1s2 2s2 2p2 or [He] 2s2 2p2 | |||||
| Fiziki xassələr | ||||||
| Halı | ||||||
| Sıxlığı | (0 °C, 101.325 kPa) 2.267 q/sm³ q/L | |||||
| Ərimə temperaturu | 3500–4700 °C (4027-4427 K, °F) | |||||
| Qaynama temperaturu | 4000 °C (3727 K, °F) | |||||
| Elektromənfiliyi | ||||||
| Oksidləşmə dərəcəsi | -4, -3, -2, -1, 0, +1, +2, +3, +4 | |||||
| Spektr = | ||||||
| İonlaşma enerjisi | kCmol-1 | |||||
Karbon (C) – D.İ. Mendeleyevin elementlərin dövri sistemində 6-cı element.
Karbon Mendeleyevin dövri sistem cədvəlində 2-ci dövr, 4-cü qrupda yerləşir. Karbonla eyni yarımqrupa silisium Si, germanium Ge, qalay Sn, qurğuşun Pb elementləri daxildir. Valent elektronlarının sayı 4-dür.
Karbon təbiətdə çox tapılan qeyri-metal kimyəvi elementdir. Kainatda yayılmasına görə altıncı yerdədir. Dünyada həm təbii, həm də mürəkkəb birləşmələr şəklində olan karbon ağırlıq olaraq Yer qabığının təxminən 0,2% — ni təşkil edir. Atmosferin isə təxminən 0,05% — ni təşkil edən karbon dioksid, mərmər kimi karbonat minerallarının, kömürün, neftin, təbii qazın əsas elementlərindən olan hidrokarbonatların və s. tərkibində vardır. Birləşmələrin 94% — in (4 milyondan çoxunun) tərkibində karbon vardır.
Xüsusiyyətləri[redaktə | mənbəni redaktə et]
Canlılardakı maddənin təxminən 18 % — ni karbon birləşmələri (geriyə qalanı əsasən sudur) təşkil edir. Bu birləşmələr canlı hüceyrələrdə əsasən yeni huceyrə yaradılmasında istifadə olunur. Həmin karbon birləşmələri yaşıl bitkidə işıq vasitəsi ilə yenilənir. Orqanizm öldükdə xarici mühitlə karbon arasında mübadilə dayanır və geriyə qalan radioaktiv karbon-14 izotopu (14C) bioloji mənşəli maddələrin yaşının təyin edilməsində istifadə olunur.
İnkişaf etmiş olkələrin iqtisadiyyatlarının böyük bir hissəsini karbon olan yanacaqların, plastiklərin, kimyəvi maddələrin və dərmanların istehsalına əsaslanır. Karbon əsaslı sintetik birləşmələrin istehsalı və istifadə edilməsi bir çox ölkələrdə həyat səviyyəsinə dərindən təsir etmişdir.
Karbonun ən çox olan izotopu, təbii karbonun 98,89%-ni təşkil edən karbon-12 (12C) izotopudur. Tam olaraq 12 a.k.v dəyərində olan bu izotop, atom ağırlığı mövzusunda beynəlxalq standart olaraq istifadə edilər. Təbii karbonun 1,11%-ni təşkil edən karbon-13 (13C), ikinci izotoptur. Karbonun beş radioaktiv izotopu məlumdur; bunlardan karbon-14 (14C) (yaranma müddəti 5 730 il) ən stabil və ən faydalı olandır. Karbon bioelement olub orqanizmin qurulmasında və həyat fəaliyyətinin təmin olunmasında iştirak edən bütün üzvi birləşmələrin struktur vahididir (zülalların, karbohidratların, lipidlərin, nuklein turşularının, vitaminlərin, hormonların). Biosferi təşkil edən bütün canlılar karbonun birləşmələrindən qurulmuşdur.
Karbon bitkilərin kütləsinin orta hesabla 45 %-ni təşkil edir: su bitkilərində onun miqdarı 40 % -ə, yerüstü bitkilərdə 46 % -ə çatır.
Karbon atmosferdə karbon qazının tərkibinə daxildir ki, bitkilər onu havadan udur. Fotosintez prosesində karbon qazından və sudan günəş enerjisinin təsiri ilə üzvi maddələr – qlükoza, nişasta və s. əmələ gəlir. Əmələ gələn karbohidratlar bitkilərin qabıq hissəsindəki borulu-lifli topalardan ibarət floema toxumasının ələkşəkilli boruları vasitəsi ilə bitkinin bütün orqanlarına yayılır və orada onların toplanması və ehtiyatı yaranır. Qida zənciri üzrə hazır üzvi maddələr bitkilərdən heyvanlara ötürülür. Karbohidratların oksidləşməsi zamanı lazımi enerji ayrılır.
Canlıların orqanizmlərində karbon orta hesabla kütləcə 21 % -dir. Kalsium karbonatın tərkibində karbon əksər onurğasızların xarici skeletində əmələ gəlir, mərcanlarda yumurta qabığında olur. Əzələnin 2/3 kütləsi və sümük toxumasının 1/3 kütləsi karbondan ibarətdir.
Karbonlu birləşmələr həyat daşıyıcılarıdırlar: zülallar, yağlar, karbohidratlar, nuklein turşuları, vitaminlər və s.
Karbon maddələr mübadiləsi prosesləri üçün lazımdır. Orqanizmlərin həyat fəaliyyəti nəticəsində üzvi birləşmələrin oksidləşdirici parçalanması baş verir və nəticədə ətraf mühitə karbon qazı ayrılır. Bioloji mayelərdə və təbii sularda həll olmuş bu qaz həyat fəaliyyəti üçün optimal olan mühit turşuluğunu təmin edir.
Karbon birləşmələrinin oksigenin təsiri ilə oksidləşməsi su və karbon qazının əmələ gəlməsinə səbəb olur. Bu proses orqanizm üçün enerji mənbəyi rolunu oynayır. Karbon dioksid (karbon qazı) maddələr mübadiləsi prosesində əmələ gəlir və nəfəsalma mərkəzinin stimullaşdırıcısıdır, nəfəs almanın və qan dövranının tənzimlənməsində mühüm rol oynayır.
Karbon birləşmələrinin orqanizmə daxil olmasının əsas mənbələri: bütün meyvə və tərəvəzlərin nazik qabığı. Paxlalılar: noxud, göy noxud, soya, lobya, mərci. Tərəvəzlər: ispanaq, kök, turp, kələm, çuğundur, kartof, xiyar, cavan zəncirotunun yarpaqları, kərəviz, qırmızı turp. Meyvələr və giləmeyvələr: alma, gilənar, çiyələk, ərik, moruq, portağal, ananas, şaftalı, üzüm, qarağat, böyürtikən. Turş süd məhsulları, yumurta.
Karbonun insan tərəfindən daha çox istifadə olunan birləşmələri:
CO2 — karbon (IV) oksid, karbon qazı;
H2CO3 — karbonat turşusu;
CaCO3 — kalsium karbonat;
C6H12O6 — qlükoza;
CO — karbon (II) oksid, dəm qazı.
Karbon ilə bəşəriyyətin tanışlığı çox qədimlərə gedir. Karbonun kim tərəfindən kəşf edildiyi bilinmir. O da məlum deyil ki, allotropik şəkildəyişməndən olan qrafit və almazdan hansı daha əvvəl kəşf olunub.
Karbon daş kömürün 99 % -ni, boz kömürün 72 %-ni, torfun 57 % -ni təşkil edir.
Kütləsi 70 kq olan insanın bədənində 15 kq karbon vardır.
İnsan qanında karbonun miqdarı 25000 mq/l, sümük toxumalarında 28000 mq/l miqdarındadır.
Sutkada hava ilə insan orqanizminə orta hesabla 3,7 qram karbon daxil olur.
Sutkada insan orqanizmi qida məhsulları ilə birlikdə 300 qrama qədər karbon qəbul edir.
Təbabətdə karbonat turşusunun və karbon turşularının törəmələri; karbolen (aktivləşmiş kömür) qazların absorbsiyası və orqanizmdən müxtəlif toksinləri çıxarmaq üçün, qrafit (sürtkü şəklində) dəri xəstəliklərinin müalicəsində və s. istifadə olunur.
Siçanların orqanizmində karbonun kütlə payı 10,77 %, pişikdə təxminən iki dəfə çox – 20,56 % -dir.
Karbon monooksid (CO) olduqca zəhərli qazdır. Onun nəfəs alınan havada öldürücü dozası cəmi 0,2 %-dir. Dəm qazının (CO) molekulu oksigen molekulundan daha davamlıdır və qanın hemoqlobini ilə əlaqələnmə qabiliyyətinə malik olub orqanizmin toxumalarına oksigen daxil olmasını pozur.
Tərkibində CO olan texniki qazlar yanar qaz kimi istifadə olunur.
CO2 bir çox kimyəvi məhsulların (karbamid, salisil turşusu və s.) sənaye istehsalında, qaynaq üçün, qazlaşdırılmış içkilər hazırlanmasında və soyuducu reagent (quru buz) kimi istifadə olunur.
Aktivləşdirilmiş kömür (karbolen) benzol, ksilol, həlledicilər və s. kimi maddələrin təmizlənməsində, ayrılmasında və çıxarılmasında, etanolun sivuş yağından təmizlənilməsində, havanın zərərsizləşdirilməsində (məsələn, əleyhqazlarda) istifadə olunur.
Təbabətdə aktivləşdirilmiş kömür sorbsiyaedici vasitə kimi istifadə olunur, taksikologiya və qastroenterologiyada geniş istifadə edilir: qazları adsorbsiya edir və müxtəlif toksinləri orqanizmdən çıxarır.
14C izotopu radioindikasiyada, həmçinin arxeologiya və paleontologiyada istifadə olunur: tapıntının yaşını müəyyən etmək üçün.
Kömür, qrafit və almaz karbonun allotropik şəkildəyişməsidir.
Daş kömür dövrü 360-dan 286 milyon il əvvəl davam etmişdir. O dövrün çöküntülərində böyük daş kömür ehtiyatları var. Dövrün adı da buradan götürülüb. O dövrdə meşələrdə böyüyən ağacların hündürlüyü 45 metrə çatırdı. Bitki kütləsi o qədər sürətlə artırdı ki, torpaqda yaşayan onurğasız heyvanlar sadəcə ölmüş bitki materialını mənimsəməyə çatdırmırdılar və nəticədə ölmüş biokütlə getdikcə daha çox qalırdı. Daş kömür dövrünün rütubətli iqlimində bu materiallardan qalın torf yataqları formalaşmışdır. Bataqlıqlarda torf tezliklə su altına çökür və orada çöküntü təbəqələri altında qalır. Zaman keçdikcə bu çöküntü təbəqələri çöküntü süxurları yataqlarının karbonlu təbəqəsinə çevrilir. Daş kömür torfda bitkilərin daşlaşmış qalıqlarından əmələ gəlir.
Kömür[redaktə | mənbəni redaktə et]
Kömür — Bitkilər öldükdən sonra, bakteriyalar təsiriylə dəyişməyə uğrayar. Əgər su altında qalaraq dəyişməyə uğrasa, C (karbon) miqdarı artaraq kömürləşmə başlayır. C miqdarı 60% isə türban, C miqdarı 70% isə linyit, C miqdarı 80–90% isə daş kömürü, C miqdarı 94% isə antrasit adını alır.
Ağac kömürü[redaktə | mənbəni redaktə et]
Ağac kömürü — bataqlıqlarda uyğun nəm və istiliyin meydana gəlməsi, mühitin turşu miqdarının artması, lazımlı üzvi maddələrin mühitdə tapılması, çürüyən bitkilərin su altına enməsi və bataqlığın müəyyən zamanla üstünün örtülməsi kimi hadisələr nəticəsində meydana gələr.
Geoloji dövrdə iki böyük kömür meydana gəlmə dövrü vardır. Bunlardan daha köhnə olanı Karbonifer (345–280 milyon il əvvəl) və Permiyen (280–225) dövrlərini əhatə edir. Şimali Amerikanın şərqi ilə Avropadakı taşkömürü yataqlarının çoxu Karbonifer dövründə; Sibir, Asiyanın şərqi və Avstraliyadakı kömür yataqları Permiyen dövründə meydana gəlmişdir. İkinci böyük kömürleşme çağı isə Kretase (təbaşir) dövründə başladı və Tresiyer dövrü əsnasında sona çatdı. Dünyadakı linyitlerin və yağsız kömürlərin əksəriyyəti bu dövrdə meydana gəlmişdir. Kömür törədiyi bitkilərdən geriyə çox az iz qalmışdır. Kömür laylarının altında və üstündə iştirak edən qayalarda kibritotları, atquyruqları və bir çox bitki qalığında rast gəlinə bilər. Kömürlər sıxlıq, sərtlik və parlaqlıq baxımından fərqlilik göstərə bilər. Ümumiyyətlə kömür növləri bəzi qeyri-üzvi maddələr, kükürd və xlor tərkiblidir.
Sümük kömürü[redaktə | mənbəni redaktə et]
Ağac kömürünün katışıklı bir növü də, yalnız yüzdə 10 nisbətində karbon olan sümük kömürüdür. Sümük kömürü, heyvan sümüklərinin yaxşıca qırılıb havasız mühitdə yandırılması ilə əldə edilir. Sümük kömürü hər hansı bir maye ilə qızdırıldıqda, məhlulun rəngini yox edər, bu səbəblə sənayedə rəng aradan qaldırıcı olaraq istifadə edilər. Məsələn, şəkər bu üsulla təmizlənir. Çay sümük kömürü ilə qaynadıldıqda tamamilə rəngsiz hala gəlir.
Allotropik Şəkildəyişmələri[redaktə | mənbəni redaktə et]
Almaz, fullerin, qrafit, karbin, karbonun allotropik şəkildəyişmələridir. Almazdan hər karbon atomu, dörd başqa karbon atomuna bağlanaraq üç ölçülü qatı bir quruluş meydana gətirər; qrafitdə isə karbon atomları, üst-üstə yığılmış geniş, yastı lövhələr meydana gətirəcək şəkildə, iki ölçülü müstəvidə bir-birlərinə bağlanmışdır. Bu lövhələr bir-birlərinin üzərindən asanca sürüşür; qrafit yaxşı bir yağlayıcı olma xüsusiyyəti də bundan alır. Qrafit kağız üzərində iz buraxmasının səbəbi də, bu incə atom lövhələrinin qrafitdən ayrılaraq kağızın üzərində yığılmasıdır. Karbonun özlərinə xas bir quruluşu ya da forması olmayan allotropiyasına amorf karbon deyilir. Kömür bu formadadır.
Almaz[redaktə | mənbəni redaktə et]
Almaz – tanınan ən sərt təbii maddədir (Mohs şkalası ilə sərtliyi 10-a bərabərdir). Almazda C atomları sp3 hibridləşmə halındadır. Valent bucağı 109° 28'dir. Atom kristal qəfəsinə malikdir. Elektriki keçirmir. Rəngsiz və şəffaf olmasına baxmayaraq, başqa minerallarla birləşdikdə, istənilən rəngi ala bilir. Almaz, kimyəvi baxımdan reaktiv deyil, amma yüksək dərəcələrdə xüsusilə havada yanması təmin edilə bilər. 1955-ci ilə qədər, vulkan mənşəli təbii yataqlar tək almaz qaynağıykən, o tarixdən bu yana qrafitin 100000MPa təzyiq və 1200 'C temperatur ilə çevrilməsindən də əldə edilir. (ləl-cəvahirat xüsusiyyətində almazlar bu üsulla əldə edilə bilməz).
Qrafit[redaktə | mənbəni redaktə et]
Qrafit – karbonun geniş bir allotropudur. Yumşaq, yağlı, kağızda iz buraxan, qara rəngli bir qatı maddədir. Qrafitdə hər bir karbon atomu eyni müstəvidə olan digər üç atoma altıbucaqlı halqalar meydana gətirəcək şəkildə bağlanır. Yaranan rabitə iki ölçülüdür və bu şəkildə meydana gələn təbəqələr bir-birinə zəif Van der Waals qüvvəti ilə bağlanır. Buna görə, təbəqələr bir-birlərinin üzərindən asanca sürüşür. Qrafit, yağ halına gətirilib maşınlarda, çalışan parçaların bir-birinə sürtülərkən aşılmasını azaltmaq ya da maneə törətmək məqsədiylə yağlayıcı olaraq istifadə edilər. Sadə karandaşların içindəki uc da, içinə gil qatılaraq bir az sərtləşdirilmiş qrafitdir. Qrafit əldə edildiyi əsas yerlər Şri-Lanka, Sibir, Şimali Amerika və Meksikadır. Qrafit, kokömürünün çox yüksək dərəcələrdə xüsusilə işlənməsiylə süni olaraq da istehsal edilə bilər. Qrafit çox yüksək istiliklərə dözə bilər, həm də çox yaxşı bir elektrik keçiricidir. Bu səbəblə, paltaryuyan maşın və elektrik süpürgə kimi elektrik mühərriklərinin fırçaları qrafitdən edilir. Son dövrlərdə, kosmos kapsulalarının istilik qalxanlarının istehsalında da qrafitdən istifadə olunmağa başlanmışdır.
Fülleren[redaktə | mənbəni redaktə et]
Fülleren — sp2 hibridləşmə halındadır.Digər birləşmələr kimi atom kristal qəfəs əmələ gətirir.Quruluşu əsasən futbol topunu, bəzi hallarda yemişi xatırladır.Valent bucağı 120'-dir.
Karbin[redaktə | mənbəni redaktə et]
Karbin — narın, qara kristallik tozdur. Elektriki keçirmir. 2 cür karbin vardır: α karbin (poliin), β karbin (polikumulen). C atomları sp hibridləşmə halındadır.