Heterotsiklik birləşmələr
Heterotsiklik birləşmələr ( heterotsikllər) – üzvi birləşmələr olub, tərkibində karbon atomu ilə yanaşı başqa elementlərin atomları da mövcud olur. Onlara həm də tsikldə heteroəvəzləyici (heteroatomlar) olan karbotsiklik birləşmələr kimi də baxmaq olar. Azot saxlayan aromatik heterotsiklik birləşmələr ətraflı öyrənilmişdir. Nadir halda, heterotsiklik birləşmələrdə tsikldə karbon atomu olmur, məs., pentazol.
Ümumi xassələri[redaktə | mənbəni redaktə et]
Tsiklda karbon atomlarından başqa digər element atomları (heteroatomlar) iştirak edən birləşmələrə heterotsiklik birləşmələr deyilir. Üzvi birləşmələrin ən çox yayılmış qruplarından biri heterosiklik birləşmələrdir. Heterotsiklik birləşmələr nuklein turşuları, xlorofil, alkaloidlər, penisilinlər və bir çox vitaminlər kimi təbii mənşəli maddələrin bir hissəsidir. Heterotsiklik birləşmələr metabolik proseslərdə mühüm rol oynayır və yüksək bioloji aktivliyə malikdir. Müasir dərman maddələrinin əhəmiyyətli bir hissəsinin strukturunda heterotsikllər var.
Təsnifatı[redaktə | mənbəni redaktə et]
Heterotsiklik birləşmələri təsnif etmək üçün aşağıdakı xüsusiyyətlərdən istifadə edilir:
- Tsiklin ölçüsünə görə;
- Tsiklə daxil olan elementin növünə görə;
- Tsiklə daxil olan heteroatomların sayına görə;
- bir neçə heteroatomun təbiəti və qarşılıqlı düzülüşünə görə ;
- doyma dərəcəsinə görə;
- tsiklin sayına görə.
Reaksiyaya girmə qabiliyyəti[redaktə | mənbəni redaktə et]
Heterotsiklik birləşmələrin reaksiyaya girmə qabiliyyəti onların qeyri atisiklik analoqlarının reaksiyaya girmə qabiliyyətinə yaxındır. Heteroatomlar kimi çox vaxt ikinci dövr elementləri (N, O) və S, təsadüf hallarda Se, P Si və başqaları istifadə olunur. Karbotsiklik birləşmələrdə olduğu kimi heterotsiklik birləşmələr aromatik heterotsiklik birləşmələrin xassələrini daşıyır (heteroaromatik birləşmələr). Karbotsiklik aromatik birləşmələrdəki karbon atomundan fərqli olaraq, heteroatomlar aromatik sistemə yalnız bir deyil (piridin tipli heteroatomlar), eləcə də iki elektron (pirrol tipli heteroatom) verə bilir.Pirrol tipli heteroatomlar adətən beş üzvlü tsikllərin tərkibində olur (pirrol, furan, tiofen). Bir heterotsikldə hər iki tip heteroatom ola bilir (imidazol, oksazol). Heteroaromatik birləşmələrin reaksiyaya girmə qabiliyyəti tsikldə elektron paylanmanın sıxlığından asılıdır.
Nukleofilliyi[redaktə | mənbəni redaktə et]
Bir heteroatomlu beş üzvlü heterotsiklik birləşmələr (pirrol tipli) üçün elektronlar hər beş atomda aromatik sekstet elektronları elə paylanır ki, onların nukleofilliyi yüksək olur. Bu birləşmələr üçün elektrofil əvəzlənmə reaksiyaları xarakterikdir, belə ki, piridinin azotu üzrə asanlıqla protonlaşır, yumşaq şəraitdə karbon tsikldə halogenləşir və sulfolaşır. Elektrofil əvəzlənmə reaksiyalarında reaksiyaya girmə qabiliyyəti azalma sırası ilə gedir: pirrol > furan > selenofen > tiofen > benzol. Piridin tipli altı üzvlü heterotsiklik birləşmələrdə benzolla müqayisədə elektron sıxlığının aşağı olması bu birləşmələrin nukleofilliyini aşağı salır. Elektrofil əvəzlənmə reaksiyaları sərt şəraitdə gedir. Belə ki, piridin oleumla 220-2700 C-də sulfolaşır.
Heteroatomların nukleofilliyi[redaktə | mənbəni redaktə et]
Azot tərkibli heterotsiklik piridin tipli azotlu birləşmələrdə π-elektron sıxlığı xüsusən azot atomunda yüksək həddə çatır. Piridin üçün π-elektron sıxlığı aşağıdakı kimi hesablanır :
| Atomun vəziyyəti | Elektron sıxlığı |
|---|---|
| 1 (N) | 1.43 |
| 2 (α) | 0.84 |
| 3 (β) | 1.01 |
| 4 (γ) | 0.87 |
Elektrofilliyi[redaktə | mənbəni redaktə et]
Heteroaromatik birləşmələrin elektrofilliyi π-elektron sıxlığı aşağı düşdükcə yüksəlir, yəni heteroatomların sayı artdıqca, beş üzvlülərə nəzərən altı üzvlülərdə yüksək olur. Belə ki, pirrol və indollar üçün nukleofil əvəzlənmə reaksiyaları tipikdir, piridin və benzimidazol natrium amidlə aminləşir, ancaq 1,3,5-triazin isə sulu məhlulda ammonium formiata qədər asanlıqla hidrolizləşir.
Əvəzləyicilərin və yan zəncirlərin reaksiyaya girmə qabiliyyəti[redaktə | mənbəni redaktə et]
Qeyri aromatik heterotsikllərin reaksiyaya girmə qabiliyyəti onların asiklik analoqlarına yaxındır. Heteroaromatik birləşmələrdə yan zəncirdə reaksiyaya girmə qabiliyyəti mezomer effektə birbaşa təsir edir. 2- və 4- əvəzlənmiş piridində metilen oksidin turşuluğu yüksək olur : belə ki, 2-metilpiridini (α-pikolin) formaldehid ilə kondensləşdirdikdə əmələ gələn 2-etoksietil-2-piridini dehidratlaşdırmaqla sənaye üsulu ilə 2-vinilpiridin sintez etmək olar.
Nomenklatura[redaktə | mənbəni redaktə et]
Heterotsikllərin təsnifatı tsikldəki heteroatomlara və onların sayına görə aparılır. Tsikildə bir neçə heteroatom olduqda onların nömrələnməsi aşağıdakı ardıcıllıqla aparılır: O, S, N. Molekulda NH və üçlü azot olduqda 1 rəqəmi ilə NH işarələnir və belə ardıcıllıq gözlənilir : O, S, NH, N. Heterotsiklik birləşmələrdə trivial və heç bir qaydaya uyğun olmayan adlar verilmişdir. Heterotsiklik birləşmələrin sistematik nomenklaturası aşağıda göstərilən Qanç və Vidman qaydası ilə sıralanır.
| Bir heteroatomlu sadə heterotsikllər | |||||||
|---|---|---|---|---|---|---|---|
| Doymuş heterotsikl | Doymamış heterotsikl | ||||||
| Heteroatom | Azot | Oksigen | Kükürd | Azot | Oksigen | Kükürd | |
| Üçüzvlü | |||||||
| Sistematik adı | Aziridin | Oksiiran | Tiiran | Azirin | Oksiren | Tiiren | |
| Trivial adı | Etilenimin | Etilenoksid | Etilensulfid | - | - | - | |
| Quruluşu |  |
 |
 |
 |

| ||
| Dördüzvlülər | |||||||
| Sistematik adı | Azetidin | Oksetan | Tietan | Azet | Okset | Tiet | |
| Trivial adı | 1,3-Propilenimin | Trimetilenoksid | Trimetilensulfid | Azatsiklobutadien | - | - | |
| Quruluşu | 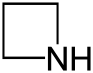 |
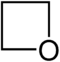 |
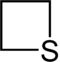 |
 |
 |

| |
| Beşüvlülər | |||||||
| Sistematik adı | Azolidin | Oksolan | Tiolan | Azol | Oksol | Tiol | |
| Trivial adı | Pirrolidin | Tetrahidrofuran | Tetrahidrotiofen | Pirrol | Furan | Tiofen | |
| Quruluşu | 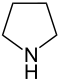 |
 |
 |
 |
 |
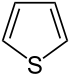
| |
| Altıüzvlülər | |||||||
| Sistematik adı | Azinan | Oksan | Tian | Azin | Oksinium | Tiinium | |
| Trivial adı | Piperidin | Tetrahidropiran | Tetrahidrotiopirn | Piridin | Pirilium | Tiopirilium | |
| Quruluşu | 60px | 70px | 70px | 70px |  |
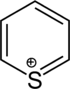
| |
| Yeddiüzvlülər | |||||||
| Sistematik adı | Azepan | Oksepan | Tiepan | Azepin | Oksepin | Tiepin | |
| Trivial adı | Heksametilenimin | Heksametilenoksid | Heksametilensulfid | Azatropiliden | Osatsikloheptatrien | - | |
| Quruluşu | 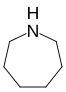 |
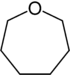 |
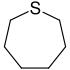 |
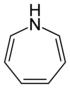 |
 |
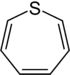
| |
Bioloji əhəmiyyəti[redaktə | mənbəni redaktə et]
Heterotsiklik birləşmələr canlı təbiətdə çox geniş yayılmışdır və təbii kimyəvi birləşmələrdə və eləcə də biokimyada mühim yer tutur.Bu birləşmələrin əmələ gəlmə funksiyası çox genişdir.
İstehsalı və tətbiqi[redaktə | mənbəni redaktə et]
Bəzi heterotsiklik birləşmələri daş kömür qətranından (piridin, xinolin, akridin və s.) və bitki yağı mənşəli xammaldan (furfurol) işləməklə alırlar. Bir çox təbii və sintetik heterotsiklikbirləşmələr qiymətli boyaq (indiqo), dərman vasitələri (xinin, morfin, akrixin, piramidon) kimi istifadə edilir. Heterotsiklik birləşmələrdən plasmas istehsalında, kinofoto sənayesində, kauçukun şişirdilməsində sürətləndirici kimi istifadə edilir.
Mənbə[redaktə | mənbəni redaktə et]
•Revision of the extended Hantzsch-Widman system of nomenclature for heteromonocycles (Recommendations 1982) // IUPAC