Spirtlər
Spirtlər — karbon atomuna birbaşa -OH qrupunun bağlı olduğu üzvi maddələrə verilən ümumi ad. Ümumi formulları CnH2n+1OH olan monospirtlər, spirtlərin önəmli bir sinfidir. Bunlardan etanol (C2H5OH), alkoqollu içkilərdə mövcud olan növdür. Ümumiyyətlə spirtli içkilərdəki alkoqol sözü ilə etanol nəzərdə tutulur, hansı ki yeni istehsal olunmuş pivədə etanolun faiz nisbəti %3 — %5 arasında, şərabda isə %12 — %15 arasında olur.[1]
Spirtlərin adlandırılması[redaktə | mənbəni redaktə et]
Spirtlər bir neçə üsulla adlandırırlar. Məsələn, radikalın adından sonra "spirt" sözünü artırırlar. məsələn, metil spirti, izopropil spirti. ikinci adverməyə görə (UPAC beynəlxalq nomenklaturaya görə) ilkin karbohidrogenin strukturuna "ol" şəkilçisini əlavə edirlər. Məs., metanol, 2-metil-1-butanol. Çox vaxt trivial advermədən də istifadə edirlər. Məs: alil spirti, benzil spirti, 0-salisil spirti.
İkiatomlu spirtlər çox vaxt diollar və yaxud qlikollar adlandırılır. Məs., 1,2-etandiol-etilinqlikol, 1,2-propandiol — propilenqlikol.
Üçatomlu spirtlər triollar, yaxud qliserinlər adlandırılır. Məs., 1,2,3-propantriol, 2,2-di(hidroksimetil)- 1,3-propansiol, pentaeritrin. Ümumiyyətlə spirtləri başqa cür alkahollar da adlandırırlar. Əgər molekulda hidroksil qrupundan böyük funksional qruplar varsa hidroksil qrupunu adlandırmaq üçün "oksi" sözündən istifadə edirlər. Məsələn, 3-oksibutan turşusu.
Doymuş biratomlu spirtlər[redaktə | mənbəni redaktə et]
Qədim zamandan məlum olan və ən çox işlənən spirt, şərab spirti, yaxud etil spirtidir. Emprik düsturu C2H6O olan bu spirtin quruluşunu təyin etmək üçün C2H6O tərkibli maddənin yalnız iki quruluşda yazmaq mümkün olduğunu nəzərə almaq lazımdır:
- CH3–O–CH3
- CH3–CH2OH
Deməli, spirtin quruluşu göstərilən bu iki formuldan biri olmalıdır.Bunu aydınlaşdırmaq üçün həmin spirtin xassələrini öyrənirlər. Məlumdur ki, etil spirtinə natriumla təsir etdikdə bir hidrogen atomu çıxır və aşağıdakı tənlik üzrə natrium-alkoholyat alınır:
- C2H5OH+Na→C2H5ONa+H
Alkoholyatda qalan beş hidrogeni isə natriumla əvəz etmək mümkün deyil.
Metanol[redaktə | mənbəni redaktə et]
Saf metanol 64,6 ℃ dərəcədə qaynayan axıcı bir maye olub, parlaq olmayan mavi alovla yanır. Çox az miqdarda belə metanol canlı orqanizm üçün zəhərlidir.
Etanol[redaktə | mənbəni redaktə et]
Etanol insan bədənində sintez oluna bilən yeganə spirt növüdür. Etanol zəhərlənmələrində padzəhər (zəhərlənməyə qarşı vasitə) olaraq istifadə edilir. Sənayedə istehsalı aşağıdakı reaksiya üzrə aparılır.
CH2=CH2+H2O → CH3-CH2-OH
Spirtlərin izomerləri və adları[redaktə | mənbəni redaktə et]
Metil və etil spirtlərinin izomerləri yoxdur. Propil spirtinin iki izomeri vardır. Propanın bir hidrogenini hidroksil qrupu ilə əvəz etsək, iki spirt almaq olar:
- CH3–CH2 – CH2OH
- CH3 – CHOH – CH3
Bunlar birli propil spirti, yaxud normal propil spirti və ikili propil spirti, yaxud izopropil spirti adlanır.
Spirtlərin fiziki xassələri[redaktə | mənbəni redaktə et]
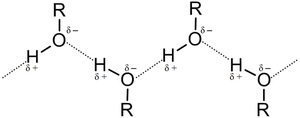
Hidroksil qrupunun polyarlığı və onun hidrogen rabitəsini əmələ gətirməsi spirtlərin mühüm fiziki xassəsidir. Bunun nəticəsində onlar yüksək temperaturda qaynamaqla suda yaxşı həll olurlar. Fiziki xassələrinə görə spirtlər karbohidrogenlərdən fərqlənirlər. Spirtlərin ilk üç nümayəndəsi suda istənilən nisbətdə, sonrakı nümayəndələri isə məhdud miqdarda həll olurlar. Çoxatomlu spirtlər biratomlulardan daha yaxşı həll olur. Bu molekulların tərkibində güclü polyar qrupun -OH olmasından irəli gəlir. Su və spirt molekullarının hər birində eyni polyar qrupların olması müxtəlif molekulların bir-birinin yanında saxlamasına imkan verir. Ancaq bu xüsusiyyət kiçik molekullu spirtlər üçün özünü doğruldur. ali spirtlərdə uzun alkil radikalının olması nəticəsində -OH qrupunun təsir effekti itir.
Spirtlərin qaynama temperaturları anomal olaraq müvafiq karbohidrogenlərin qaynama temperaturlarından yüksəkdir. Spirtlərin molekul çəkisi artdıqca qaynama temperaturlarıda yüksəlir. Belə ki şaxəli quruluşlu spirtlərin qaynama temperaturları normal quruluşlu spirtlərdən aşağıdır. Metil spirti 64,7oC-də qaynayan mayedir. Sonrakı normal quruluşlu spirtlərdən, tərkibində 12-yə qədər karbon olan spirtlər maye, 12-dən çox karbonu olan spirtlər isə bərk maddələrdir. Bunların molekul kütlələri artdıqca qaynama temperaturları, ərimə temperaturları, sıxlıqları yüksəlir. normal birli spirtlərin qaynama temperaturları üçün homoloq fərqi təxminən 20o-dir. Spirtlər sudan yüngüldür. metil, etil, propil spirtləri su ilə qarışır, sonrakı spirtlərin suda həll olması (molekul çəkisi artdıqca) azalır. Bərk spirtlər suda çox pis həll olur. Birinci spirtlər araq iyi verir. Orta nümayəndələri kəskin iyli, ali spirtlər isə iysizdir. Bütün spirtlərdən yalnız etil spirti içməyə yararlı, qalan spirtlər isə zəhərlidir.
Alkoholların sıxlıqları suyun sıxlığından aşağı olduğu halda aromatik spirtlərinki vahiddən böyükdür.
Spirtlərin tətbiqi[redaktə | mənbəni redaktə et]
Spirtlər çox geniş tətbiq sahələrə malikdirlər. İlk növbədə onlar müxtəlif birləşmələr:alkenlər, aldehidlər, efirlər, turşuların alınmasında istifadə edilir.
Metanol əsasən müxtəlif birləşmələrin metilləşdirilməsində, yəni metil qrupunun molekula daxil edilməsində istifadə edilir.
Etanol isə etilləşdirmək üçün istifadə edilir. Sənayedən etil spirti tonlarla istehsal edilir, çünki ondan divinil, dietil efiri, xloroform, etilasetat alınır.
Metanoldan dünyada ildə 30 mln.ton istehsal edilir. Bunun əsas hissəsi avtomobillərdə yanacaq kimi yandırılır. Təkcə Braziliyada ildə bir milyon ton metanol alınır. Metanol istənilən sinif üzvi birləşmələr almaq üçün perspektivli və təmiz xammaldır. Metanol həmçinin formaldehid, metakrilat və lavsan istehsalında, həmçinin yaxşı həlledici kimi istifadə edilir.
Propil spirtindən propion aldehidi və bir sıra dərman maddələri alınır.
İzopropil spirti yaxşı həlledici olmaqla suyu özünə aktiv çəkdiyinə görə təyyarə qanadlarını buzlaşmadan qorumaq üçün istifadə edilir.
Butil spirtindən müxtəlif məqsədlərdən ötrü: plastifikator (ftal və digər ikiəsaslı turşuların efirləri kimi) həlledici (əsasən 2-butanol) və sintetik yuyucu maddələrin istehsalında istifadə edilir.
Etilenqlikol antifriz komponenti (tosol) kimi istifadə edilir.
Qliserinin özlülüyü və şirin dadına görə onu likyorlara və şirniyyat məhsullarına qatırlar. Ondan kəskin ürək ağrısı zamanı dərman kimi istifadə edilən trinitral- "nitroqliserin" alınmasında istifadə edilir. Bundan başqa nitroqliserin dəhşətli partlayıcı maddə olduğundan Alfred Nobel ondan dinamit hazırlamağı təklif etmişdir.
Fenol güclü və klassik antiseptik maddədir. İngilis həkimi C.Listerin təklifi ilə fenolun sulu məhlulundan mikroblara qarşı istifadə edilir. Fenol orqanizmə mənfi təsir göstərdiyindən ondan az istifadə edilir.
Məlumdur ki, Aralıq dənizi sahillərində yaşayan xalqlar dörd min ildən çox üzüm şirəsini qıcqırtmaqla şərab almışlar.
Spirtlərin alınması[redaktə | mənbəni redaktə et]
- Sənaye metodları
Alkenlərin hidratlaşması — ən çox istifadə olunan və tətbiq edilən metoddur. Böyük miqdarda sənayedə alınan alkenlər (əsasən etilen) asanlıqla alkohollara çevrilir.
Karbohidratların və zülalların hidrolizi — maya və fermentlərin təsiri ilə şəkərin — karbohidratların hidrolizi ən qədim reaksiyalardan biridir. Şəkəri şəkər çuğundurundan, nişastanı isə kartofdan alırdılar. bu reaksiyalar əhəmiyyətini indiyə qədər itirməmişdir. etil spirti hal-hazırda bu yolla alınır.
Alkilhalogenidlərin hidrolizi — İlk dəfə spirti sintetik yolla 1858-ci ildə Bertlo almışdır.
CH4→CH3Cl→CH3OH
Oksosintez (hidroformilləşmə) — bu karbon oksidinin və hidrogenin alkenlərə birləşməsi reaksiyasıdır.
Parafinlərin oksidləşməsi — sintetik yuyucu maddələrin sintezi üçün istifadə olunan ali doymuş spirtlər parafinlərin oksidləşməsindən alınır.
- Spirtlərin preparativ sintez metodları
Qrinyar sintezləri spirtlərin maqnezium üzvi birləşmələrin karbonilli birləşmələrlə — aldehidlər, ketonlar, mürəkkəb efirlər və s. qarşılıqlı təsiri ilə alırlar. Hidroborlaşma-oksidləşmə
Aldehidlər, ketonlar, mürəkkəb efirlər və üzvi turşuların reduksiyası (karbonilli birləşmələr)
Spirtlərin kimyəvi xassələri[redaktə | mənbəni redaktə et]
Spirtlərdə xarakterik hidroksil qrupunun olması onların xassələrini müəyyənləşdirir. C-O və O-H rabitələri olduqca möhkəmdir, belə ki onların rabitə enerjisi 80….199 kkal/mol olduğundan, radikal reaksiyalara çətinliklə daxil olur. Ancaq oksigen yüksək elektromənfi element (flüordan sonra ikinci elementdir) olduğundan ion reaksiyalarında bu rabitələr asanlıqla qırılır. O-H rabitəsi güclü polyarlaşsığından hidrogenin yüksək mütəhərrikliyini gözləmək olar. Ancaq spirtlər suya nisbətən zəif turşulardır. Bu alkil qruplarının elektrodonor (+I) effekti ilə əlaqədardır. Onların təsirindən oksigen atomu üzərində elektron sıxlığı artır və hidrogenin aktivliyi azalır. yuxarıdakılara əsasən alkoholyat ionlar RO- hidroksil OH- ionuna nisbətən daha çox əsasi xassəyə malikdirlər.
Spirtlər turşu kimi[redaktə | mənbəni redaktə et]
Spirtlərin turşuluq xassəsini onların aktiv metallarla (məsələn qələvi metallarla) reaksiyalarından aydın şəkildə görmək mümkündür
- 2R-O-H + 2 Me → 2 R-O-Me + H2
- 2 °C2 H5 OH + 2 K → 2 °C2 H5 OK + H2
Reaksiya şiddətlə və istiliyin ayrılması ilə gedir. Suya nisbətən alkoholyatlar əsasi xassəli olduğundan onların hidrolizi nəticəsində spirtlər əmələ gəlir.
- 2 °C2 H5 OK + H2O→ 2 °C2 H5 OH + H2 + KOH
- R-O-K + H2O → R-O-H + K+OH-
Birli spirtlərdən üçlü spirtlərə keçdikcə turşuluq azalır. Spirtlər güclü turşular kimi Qrinyar reaktivinin karbanion mərkəzini protonlaşdıraraq sonuncunun dağıdılmasına səbəb olur.
Spirtlər əsas kimi[redaktə | mənbəni redaktə et]
Spirtlər əsaslar kimi oksigenin sərbəst elektron cütlərinə turşunun protonunu birləşdirmək qabiliyyətinə malikdirlər. Nəticədə oksonium ionu əmələ gəlir ki, o da xlor anionu ilə oksonium duzunu (ammonium duzunun analoqu kimi) əmələ gətirir. bu duzlar davamsız olduqlarından parçalanaraq alkilhalogenidlər əmələ gətirirlər.
R-OH+HCl → R-O+-H -HCl-
RO+H2 → R+ → R-Cl
Halogenidlərin alınması[redaktə | mənbəni redaktə et]
Məlumdur ki, yuxarıda göstərilən reaksiya-alkilhalogenidlərin alınması üçün əsas reaksiyalardan biridir. Spirtlər hidrogenhalogenidlərlə asanlıqla reaksiyaya girirlər. Reaksiyanı ya qatı xlorid turşusundan istifadə etməklə, ya da spirtdən qaz halında hidrogen-xlorid buraxmaqla aparırlar.
2C2H5OH + HCl → 2C2H5Cl+H2O
Bəzən spirtləri metalların halogenidləri və sulfat turşusu ilə birgə qaynadırlar.
C3H7OH + NaBr + H2SO4 → C3H7Br + NaHSO4 + H2O
Spirtlərin quruluşundan asılı olaraq reaksiya iki mexanizm üzrə gedə bilir : SN1 və SN2
Alkilhalogenidləri həmçinin spirtlərin tri- və pentahalogenid fosfatlarla qarşılıqlı təsirindən almaq mümükündür
3C3H7OH + PCl3 → 3 °C3H7Cl + H3PO3
ROH + PCl3 → RCl + HCl + POCl3
Halogenidləri eyni zamanda spirtlərin tionilxloridlərlə reaksiyasından da almaq mümükündür.
C2H5OH + SOCl2 → C2H5Cl + SO2 + HCl
İstinadlar[redaktə | mənbəni redaktə et]
- ↑ "Chemistry and Decision Making. Alcohol Chemistry and You". 2011-03-05 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 2013-06-23.
Mənbə[redaktə | mənbəni redaktə et]
- S.F.Qarayev, U.B.İmaşev, G.M.Talıbov "Üzvi kimya", Bakı-2003.